Soweit uns bekannt ist, liegen derzeit keine hinreichenden Anhaltspunkte vor, dass gefälschte Ozempic® Produkte über den vollversorgenden Großhandel in Deutschland in eine Apotheke und auf diesem Weg bis zu Patient:innen gelangt sind. Insgesamt schätzen wir das Risiko für Patient:innen, in einer Apotheke in Deutschland gefälschte Ozempic® Produkte zu erhalten, aktuell als gering ein.
Als gefälscht identifizierte Ware sollten keinesfalls verwendet und
von Patient:innen unmittelbar in eine Apotheke gebracht werden, da
bei Anwendung ein Gesundheitsrisiko besteht. Abbildungen von
Original und Fälschung sind z.B. auf der Website des BfArM
verfügbar: BfArM - Arzneimittelfälschungen - Fälschung des
Arzneimittels Ozempic®
Der beste Schutz vor Fälschungen besteht darin, Arzneimittel
nur mit ärztlichem Rezept über eine Apotheke zu beziehen.
Fälschungen unserer Medikamente verurteilen wir auf das Schärfste, da sie die Sicherheit der Patient:innen gefährden können. Im aktuellen Fall sind wir mit den zuständigen Behörden in Deutschland in engem Austausch und untestützen bestmöglich bei der Aufklärung.
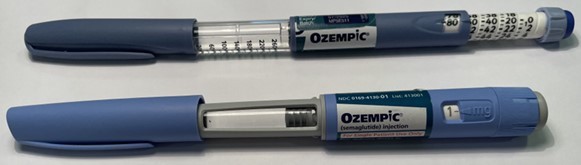
Fälschungen sind vom Original leicht unterscheidbar:
- Fälschung und Original sind optisch verschieden, z.B. ist bei dem Original-Pen der drehbare Ring im hinteren Bereich hellblau, bei der Fälschung dagegen grau. Der Injektionsknopf ist beim Original grau, bei der Fälschung blau.
- Anders als beim
Original können bei der Fälschung keine Milligramm
eingestellt werden, stattdessen ist bei der Dosisvorwahl eine
aufsteigende Zahlenskala sichtbar. Die Skala des gefälschten Pens
reicht von 0 bis 80, der Dosiswahlschalter verlängert sich bei der
Einstellung der Dosis. Zum Vergleich: Beim 1 mg Ozempic®
Fertigpen kann nur eine Dosis von 1 mg eingestellt werden, es werden
keine weiteren Dosierungen angegeben.
- Anders als beim Original, bei dem an der Patronenhalterung keine Skalierung angegeben ist, sieht die Fälschung an der Patronenhalterung eine Skalierung von 260 bis 20 vor.
Karrieremöglichkeiten
Hier findest du aktuelle Stellenangebote. Sollte kein passendes Profil für dich dabei sein, kannst du unseren Jobagenten nutzen oder dir ein Kandidatenprofil anlegen.
In den vergangenen Monaten gab es sowohl in Deutschland als auch in anderen Ländern eine erhöhte Nachfrage nach verschreibungspflichtigen Medikamenten zur Behandlung von Diabetes Typ 2 oder Adipositas. Diese Medikamente werden nicht nur von den Patient:innen nachgefragt, sondern teilweise auch von Menschen, die nicht an diesen Erkrankungen leiden, aber von dem gewichtsreduzierenden Effekt der Medikamente profitieren möchten.
Hierzu bezieht Novo Nordisk eindeutig Stellung:
Wir empfehlen die Verwendung verschreibungspflichtiger Medikamente ausdrücklich nur innerhalb der von der Europäischen Arzneimittel-Agentur (EMA) zugelassenen Indikation. Zugleich distanzieren wir uns entschieden von jeglicher Form von Werbung, Social-Media-Posts und Berichten, die sich direkt an die Öffentlichkeit in Deutschland und in anderen Ländern richten und zum nichtbestimmungsgemäßen Gebrauch aufrufen oder diesen verharmlosen.
Wir tun unser Möglichstes um sicherzustellen, dass Patient:innen und Ärzt:innen über die korrekte Anwendung unserer verschreibungspflichtigen Medikamente informiert sind. Wir bitten Ärzt:innen darum, verantwortungsbewusst und ausschließlich gemäß zugelassener Indikation zu verschreiben. Jedes andere Anwendungsgebiet unserer GLP-1 Rezeptoragonisten, inkl. der Gewichtsregulierung zu kosmetischen oder Lifestyle-Zwecken, stellt eine off-label Anwendung dar und kann aktuell die Verfügbarkeit unserer Medikamente für Menschen mit Typ 2 Diabetes oder Adipositas gefährden. Unsere Haltung zum Off-Label Einsatz von GLP-1 Rezeptoragonisten entspricht auch der Ansicht des Bundesinstituts für Arzneimittel und Medizinprodukte.“
Hinweis: Wir weisen an dieser Stelle ausdrücklich darauf hin, dass die Übermittlung von Auskünften zu unseren Medikamenten ausschließlich der rein sachlich-faktischen Information dient, mit dem Ziel, Fehlinformationen zu vermeiden und eine korrekte Darstellung der Sachverhalte sicherzustellen.